Introduction
돼지 생식기 호흡기 증후군 바이러스(Porcine Respiratory and Reproductive Syndrome Virus, PRRSV)는 피막이 있는 RNA 바이러스로써 북미, 유럽, 아시아 전역의 여러 나라에서 발생하고 있으며 북미형(NA)과 유럽형(EU) 2가지 유전자형(genotype)이 존재한다. 이 중에서 2형(type2)에 속하는 북미형은 유럽형보다 호흡기 증상이 심하고 백신을 사용하므로 판별검사가 필요하다(Dewey et al., 2000; Ropp et al., 2004; Fang et al., 2007; Balka et al., 2008; Amonsin et al., 2009; Kim et al., 2009).
임상증상으로는 크게 번식장애와 호흡기 증상으로 나누어 볼 수 있는데, 호흡기 증상으로는 PRRSV 단독 감염으로는 피해가 거의 없고 2차적으로 세균성 호흡기 질병과 복합 감염 시 피해가 늘어난다. 따라서 위생 상태나 백신프로그램이 비슷한 농장에서 피해 정도가 다양하게 나타날 수 있다.
돼지 인플루엔자(Swine Influenza, SI)는, 전염성이 매우 높은 돼지의 바이러스성 감염증으로 돼지 인플루엔자 바이러스(Swine Influenza Virus, SIV)가 원인체이다. SIV는 오르토믹소바이러스과(Orthomyxoviridae)에 속하며 인플루엔자 바이러스 A형(Influenza virus type A)에 속하는 바이러스로써, 인플루엔자 바이러스 A형은 사람, 가축 및 조류 모두에서 감염이 확인되고 있다. 현재까지 16가지의 HA와 9가지의 NA가 밝혀져 있으며, 서로 조합하여 144가지 이상의 바이러스 아형(subtype)이 존재할 수 있다. 이 중 돼지에서는 H1N1, H3N2, H1N2 아형 바이러스가 주로 유행하고 있다(Zhou et al., 1999; Olsen et al., 2000; Webby et al., 2000; Webby et al., 2001; Karasin et al., 2002; Olsen, 2002).
돼지 써코 바이러스 2(Porcine Circovirus type 2, PCV2)는 이유 후 전신소모성 증후군(post-weaning multisystemic wasting syndrome, PMWS)을 유도하는 바이러스로서, PMWS는 1991년에 캐나다에서 최초로 확인되었다. 1991년 캐나다에서의 발병 이래, PMWS는 북미, 유럽, 아시아 등지의 많은 국가들에서 보고되어 왔다(Harding, 1996; Segales et al., 1997; Le Cann et al., 1997; Sorden et al., 2000). 이후, PMWS에 감염된 돼지들에서 신종 써코 바이러스가 추출되었다(Allan et al., 1998).
PCV2는 독단적으로는 증상이 발생하지 않으며, PRRS virus와 Swine influenza virus등과의 복합 감염 시 PCV2의 증식이 증가하면서 증상이 나타나게 되어 폐사하게 되는 원인이 된다(Figure 2).
상기와 같은 돼지 질병을 유도하는 바이러스들을 확인하는 것은 돼지 질병의 진단방법으로 사용할 수 있을 뿐만 아니라, 인간 장기 이식을 위해 이용할 수 있는 돼지장기를 통해 새로운 감염원이 인간에게 유입될 가능성을 방지하기 위한 진단방법으로도 사용할 수 있다.
본 연구의 목표는 상기 PRRSV, PCV2, 그리고 SIV 등 3종의 돼지 질병 바이러스를 one-step Real Time-PCR (RT-PCR) Premix를 이용하여 1회의 간단한 PCR을 통해서 확인할 수 있는 방법을 개발하고자 하였다. PRRSV와 SIV는 RNA virus이며, PCV2는 DNA virus로써 기존에는 DNA virus와 RNA virus를 따로 PCR하여 진단 시약을 사업화하였다. 하지만 본 연구자는 DNA 및 RNA를 동시에 증폭시킬 수 있는 one-step RT-PCR Premix를 개발하였으며, 이를 이용하여 3종의 virus를 동시에 증폭시킬 수 있는 multiplex RT-PCR 기법을 사용하였다. 이는 진단 시간 및 절차를 대폭 절감할 수 있으며 검사 비용 또한 낮출 수 있는 장점을 가지게 될 것으로 예상된다. 특히, PCV2는 PRRSV나 SIV에 의해 복합 감염이 발생할 경우 증상이 더욱 악화되기 때문에 PCV2에 의한 감염 시 다른 질병의 감염 여부를 확인하는 것이 중요하다. 따라서 본 연구에 의해서 3종 virus의 동시 진단 시약 개발을 한다면 질병 감염여부의 신속한 진단이 가능할 것으로 여겨진다.
Materials and Methods
공시 재료
본 연구에 이용된 PRRSV의 북미형과 유럽형, SIV의 H1N1, H1N2, H3N2, 그리고 PCV2의 genome은 전북대학교 수의과대학으로 부터 제공을 받았다. 제공받은 RNA 및 DNA의 순도 및 농도는 BioSpec Nano Spectrophotometer (Shimadzu Scientific Instrument, Japan)를 이용하여 260/280 nm에서 측정을 하였다. 각 RNA와 DNA는 PCR을 수행하기 전에 10 ng/µl로 희석하여 사용하였다.
Primer의 제작
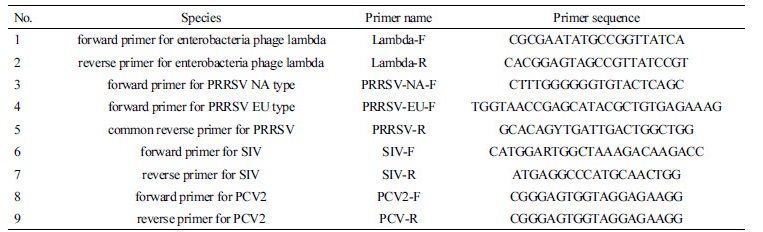
PRRSV NA type, PRRSV EU type, SIV, PCV2의 multiplex RT-PCR을 위한 primer는 Primer 3 program(www. ncbi.nlm.nih.gov)을 이용하여 제작하였다. Primer 제작 시 internal control용으로 사용하기 위하여 enterobacteria phage lambda를 이용하였다.
internal control용의 enetrobacteria phage lambda 증폭을 위한 primer는 NCBI GenBank database로부터 추출된 sequence (GenBank accession number J02459.1)내에서 제작되었다. PRRSV NA type 과 EU type의 증폭을 위한 primer는 각각 GenBank accession number AF494042.1와 GU047344.1내에서 제작하였다. SIV의 subtype H1N1, H1N2, 그리고 H3N2의 증폭을 위한 primer는 각각 GenBank accession number CY099160.1, DQ280234.1 그리고 IAU65578 내에서 제작하였다. PCV2의 증폭을 위한 primer는 GenBank accession number DQ629113.1내에서 제작하였다. multiplex RT-PCR을 위해 사용된 primer는 Table 1에 나타내었다.
각 primer를 이용하여 RT-PCR을 수행할 경우 PCR product의 크기는 internal control은 1,006 bp, PRRSV NA type은 340 bp, PRRSV EU type은 212 bp, SIV는 269 bp, 그리고 PCV2는 137 bp이다.
PCR 증폭
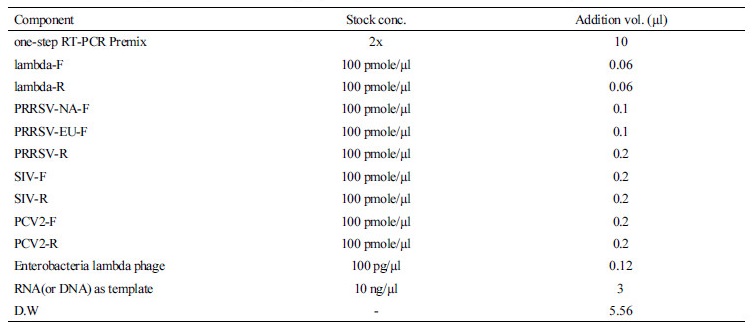
제작된 primer와 RNA 및 DNA를 이용하여 one-step RT-PCR test를 실시하였다. RT-PCR을 위한 조성은 one-step RT-PCR Premix(Genet Bio, Korea), primer mixture, template, 그리고 internal control용 enterobacteria phage lambda(Bioneer, Korea) 등으로 이루어져 있으며, 자세한 첨가량은 Table 2에 나타낸 조성으로 첨가하고 최종적으로 멸균증류수를 첨가하여 총 reaction 용량을 20 µl로 하였다.
Table 2 The list of components and volumes for polymerase chain reaction in order to detect porcine diseases
|
PCR 반응은 PRRSV와 SIV의 RNA로부터 cDNA를 합성하기 위하여 50°C에서 30분을 수행하며, Reverse Transcriptase의 불활성화 및 Taq DNA Polymerase 활성화를 위하여 95°C에서 10분간 반응시킨 후, 95°C에서 30초, 57°C에서 30초, 72°C에서 1분을 35 cycle 반복 수행하였고 마지막으로 72°C에서 5분간 수행함으로써 종료하였다(Table 3). 증폭된 각각의 PCR product들은 2% agarose gel에 전기 영동하여 증폭여부 및 크기를 확인하였다.
Results and Discussion
본 연구의 목표는 one-step RT-PCR Premix를 이용한 1회 반응으로 돼지 질병 3종을 진단할 수 있는 시약의 개발에 있다. Internal control를 포함하여 PRRSV NA type, PRRSV EU type, SIV (subtype H1N1, H1N2, and H3N2), 그리고 PCV2 등 총 5개의 target을 PCR해야 하기 때문에 적절한 primer Tm value와 시각적으로 확인 및 구별이 가능한 PCR product size를 예상을 하고 primer를 제작하였다.
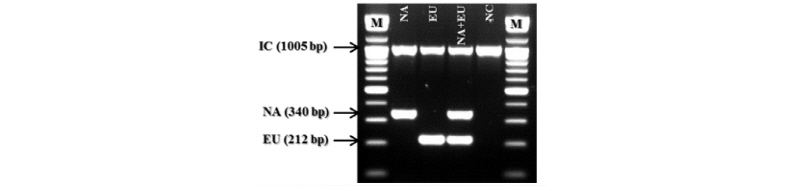
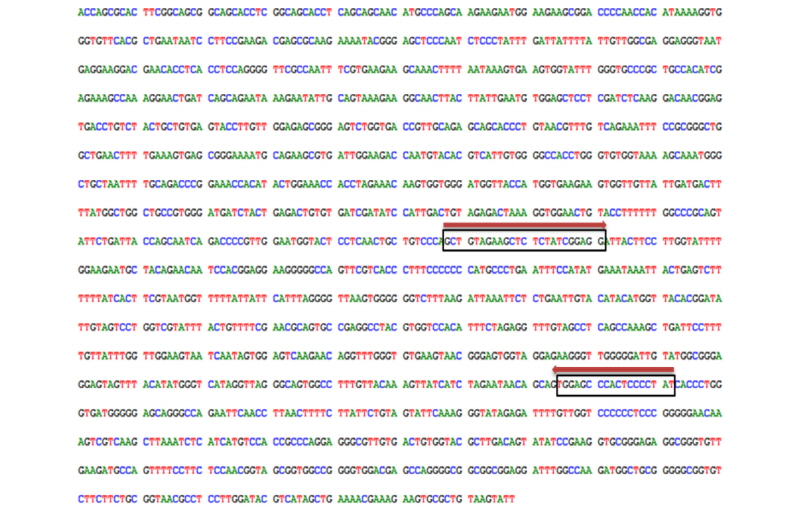
PRRSV의 경우 NA type과 EU type을 구별할 수 있도록 구성하기 위하여 DNA alignment를 진행하였으며, 변이가 거의 없는 공통된 부위를 하나의 reverse primer로 디자인하였으며, forward primer는 각 type에 특이적인 부분을 찾아서 type specific forward primer로 디자인을 하였으며, primer의 위치는 PRRSV의 nucleocapsid protein 정보를 가지는 ORF이다. Figure 1에 PRRSV의 NA type과 EU type을 검출하기 위한 primer위치를 나타내었다. 그림에서 오른쪽 방향의 화살표는 NA type과 EU type의 각 forward primer이며, 왼쪽 방향의 화살표는 공통으로 사용하는 reverse primer의 위치를 나타내고 있다.
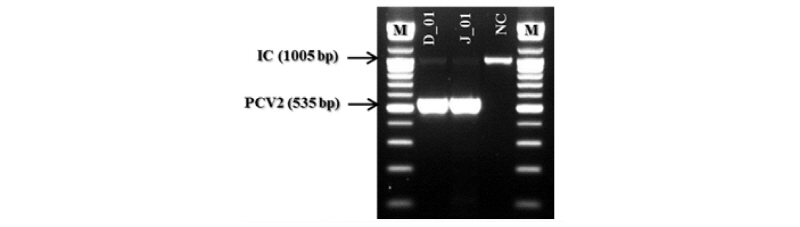
제작된 primer를 이용하여 one-step RT-PCR Premix를 이용하여 cDNA 합성 및 PCR을 진행하였다. PCR 결과를 Figure 2에 나타내었다. 그림에서 보는 바와 같이 PRRSV 검출용 primer mixture를 이용하여 PCR한 결과 비 특이적인 반응이나 교차반응이 확인되지 않았으며, NA type과 EU type을 동시에 증폭시킬 경우에도 PCR 결과에 별 문제가 발견되지 않았다.
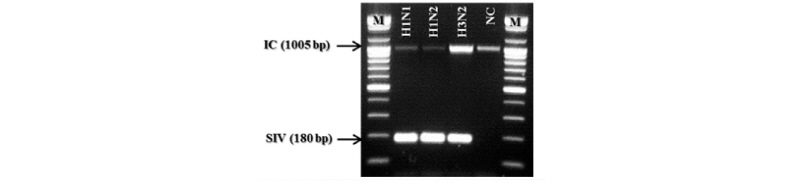
SIV는 돼지의 독감 원인체로써 subtype H1N1, H1N2, 그리고 H3N2 3가지가 주된 아형인 것으로 알려져 있다. 본 연구에서는 3가지 subtype을 동시에 확인하고자 하였으며, genome alignment를 통하여 sequence 변이가 없는 부분을 찾아서 primer를 제작하였다. Figure 3에 SIV를 검출하기 위한 primer위치를 나타내었다. 그림에서 오른쪽 방향의 화살표는 forward primer의 위치를 나타내며, 왼쪽 방향의 화살표는 reverse primer의 위치를 나타내고 있다. primer는 SIV genome의 segment 7번의 matrix protein 1에 대한 정보를 가지는 ORF에 위치하고 있다.
제작된 primer를 이용하여 one-step RT-PCR Premix를 이용하여 cDNA 합성 및 PCR을 진행하였다. PCR 결과를 Figure 4에 나타내었다. 그림에서 보는 바와 같이 SIV의 3가지 subtype에 대해서 증폭결과를 얻을 수 있었으며, 비 특이적인 반응은 확인할 수 없었다.
PCV2는 single-strand DNA virus로써 RNA virus에 비해 상대적으로 변이가 많이 존재하지 않으며, 유전적으로 유사한 PCV1에 대해서는 비 특이적인 위치를 찾아 primer를 제작하였다. Figure 5는 PCV2를 검출하기 위한 primer위치를 나타내었다. 그림에서 오른쪽 방향의 화살표는 forward primer의 위치를 나타내며, 왼쪽 방향의 화살표는 reverse primer의 위치를 나타내고 있다. primer는 PCV2 genome ORF1의 replicase protein의 정보를 가지는 부위에 위치하고 있다.
제작된 primer를 이용하여 one-step RT-PCR Premix를 이용하여 PCR을 진행하였다. PCR 결과를 Figure 6에 나타내었다. 그림에서 보는 바와 같이 PCV2 검출용 primer를 이용하여 PCR한 결과 비 특이적인 반응은 확인되지 않았다.
돼지 질병 3종을 검출하기 위하여 제작된 primer를 모두 합쳐서 PCR test를 진행하였으며 교차반응에 대한 문제점이 있는지, multiplex RT-PCR이 제대로 진행되는지를 확인하는 실험을 진행하였다. Figure 7은 각 개별 샘플 및 혼합 샘플에 대한 전기영동 사진을 나타내었다. 결론적으로 primer mixture를 이용할 경우 교차반응이 일어나지 않았으며, multiplex RT-PCR을 진행할 경우에도 문제없이 모든 질병을 확인할 수 있었다. multiplex RT-PCR test의 경우 template RNA와 DNA를 첨가할 수 있는 양이 한정적이라서 개별 sample PCR때보다 약 10배정도 적은 양을 사용하였기 때문에 상대적으로 낮은 PCR yield를 얻을 수 있었다.
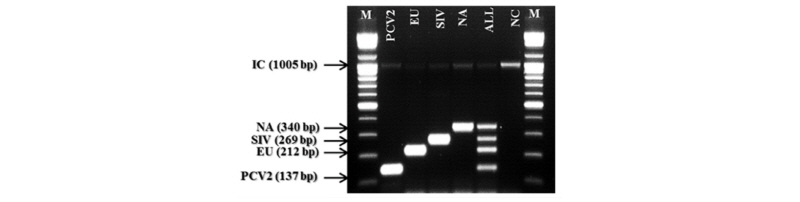
Figure 7 Multiplex RT-PCR amplification test for porcine disease detection. Lane M: 100 bp DNA Marker (Genet Bio, Korea), Lane PCV2: PCR product for PCV2, Lane EU: PCR product for PRRSV EU type, Lane SIV: PCR product for SIV, Lane NA: PCR product for PRRSV NA type, Lane All: multiplex PCR products for all sample, Lane NC: Negative control.
Conclusion
PRRSV는 North American(NA) type과 European(EU) type 두 종류의 유전자형이 있으며 RNA virus이다. PCV2는 단독으로 감염일 경우 증상이 거의 나타나지 않으나 PRRSV나 SIV 등과 같이 다른 원인체에 의해 복합 감염이 될 경우 심각한 병증을 나타내는 특징을 가지는 DNA virus이다. SIV는 돼지 독감을 유발하는 RNA virus로써 3가지 subtype(H1N1, H1N2, and H3N2)이 주를 이루고 있다.
PCV2가 PRRSV 그리고 SIV와 같이 다른 원인체에 의해 복합적으로 감염을 일으킬 경우돼지의 병증이 매우 악화되는 현상을 보이고 있다. 따라서 PCV2를 단독으로 진단하여 양성결과가 나오면 추가적으로 다른 질병에 대한 검사를 진행해서 복합 감염의 여부를 확인해야만 피해를 줄일 수 있다.
기존의 돼지 질병 진단 제품들은 하나의 질병에 하나의 진단제품만으로 구성이 되어 있기 때문에 검사비용이 비싸고 검사시간이 많이 걸린다는 단점이 있다. 또한 RNA virus와 DNA virus에 대해서는 별도의 유전자증폭시약을 사용해야 한다고 여겨졌다. 하지만 본 연구에서는 DNA virus와 RNA virus를 이용하여 동시에 증폭시킬 수 있는 one-step RT-PCR Premix를 이용함으로써 virus의 종류에 상관없이 서로 복합 감염이 가능한 원인체를 1회 test로 검출할 수 있도록 하였다. 이로 인해 진단검사 시간 및 검사비용을 줄일 수 있으며, 신속한 진단 결과가 요구되는 진단 시약의 특성을 한층 더 보완할 수 있다고 여겨진다.
향후에는 이들 질병이외에도 복합감염 가능성이 있는 마이코플러즈마, 세균성 패혈증, 그리고 세균성 폐렴 등을 동시에 진단할 수 있도록 추가함으로써 한 번의 실험으로 PCV2와 존재할 수 있는 복합감염을 확인할 수 있는 진단시약을 개발할 필요가 있을 것으로 판단된다.