서론
미니돼지는 일반돼지에서 소형화된 품종으로서 현재는 애완용으로 가장 많이 이용되고 있다. 그 이유 중 하나로써 사람에게 친숙하고 세대를 거듭해서 보다 친화된 동물로 발전해 왔으며, 애완동물로서 가장 널리 이용되고 있는 개와 비교해 보아도 지능 면에서나 주인을 따르는 행동 등에서 미니돼지가 전혀 뒤떨어지지 않기 때문이다. 하지만 본래 미니돼지의 개발 목적은 단순히 애완용으로 사육하기 위함이 아니었다.
미니돼지는 개발 당시 기존의 실험동물인 마우스, 랫, 기니피그 등을 대체하는 실험동물로서의 이용을 목적으로 개발되었다. 돼지는 기존에 실험동물로서 가장 널리 이용되고 있는 쥐보다 인간과의 유사성 면에서 훨씬 더 가깝고, 피부조직이나 장기의 크기, 내분비적인 측면에서 볼 때 그 이용가능성은 다른 어떤 동물보다도 뛰어나다고 볼 수 있다. 하지만 개발 초기에 장기이식을 목적으로 미니돼지의 소형화 개량을 시행하였으나, 그 이용성에 경제적・의학적・기술적인 제한이 많아서 그 이용은 극히 제한적으로 이루어졌고, 결과적으로 처음 개발 목적인 실험동물로서의 이용이 아닌 애완동물로서 더 널리 이용돼 왔다.
하지만 최근 의학이 발달하고, HGP (human genome project)가 완료되어 인간 유전체에 대한 정보가 확보됨에 따라 생명공학 기술이 급속도로 발달하게 되었고, 그에 따라서 미니돼지의 이용가능성도 더욱 현실성을 갖게 되었다. 따라서 미니돼지의 활용방안이 더 구체적인 목적을 갖게 되었고, 이용범위가 더 광범위해졌다. 미니돼지를 통해서 이종장기 생산이나 세포이식과 관련해서 면역거부 반응 치료제의 개발이 가능하고, 맞춤형 미니돼지의 생산으로 인간의 질병 모델로서의 활용을 통한 질병치료제의 개발도 가능하다. 또한 식품 및 의약품의 효능과 안정성 평가등을 위한 실험동물로서 미니돼지의 활용이 가능하고, 일반 의학적인 측면에서 미니돼지의 실험동물로서의 이용은 매우 광범위하다.
이처럼 미니돼지의 활용성이 급부상 되면서, 미니돼지의 실용화를 위한 선행 연구가 시급하게 되었다. 미니돼지를 이같이 활용하기 위해서는 무균화된 미니돼지의 생산이 가능해야 하고, 이와 동시에 실험목적에 맞춰서 line을 갖출 수 있도록 기초돈군이 유지되어야 할 것이다. 하지만 이보다 가장 앞서서 선행되어야 할 항목은 바로 미니돼지의 소형화이다. 앞서 언급한 실험동물로서의 미니 무균돼지는 인간과 비교하여 생물학적 유사성이 쥐에 비해 가까우나 다수의 실험동물이 실험에 사용되어야 하는 실험 특성상 쥐에 비해 고가의 실험비용이 들게 됨으로써 쥐의 사용이 선호되고 있다. 따라서 이러한 경제적인 문제점을 해결하기 위해서는 사육 및 실험 시 소비되는 비용을 절감하기 위해 초소형 미니돼지의 개발이 필요하다. 또한 실험자의 핸들링 측면에서도 미니돼지의 소형화는 절실하다고 볼 수 있다. 아무리 경제적으로도 대량 사용이 용이하고, 산업적・의학적 측면에서도 활용가능성이 높다고 하여도 실험자가 다루기 어렵거나 불편하다면, 그것은 극히 제한적으로 이용될 수 밖에 없을 것이다.
현재 미니돼지의 체중은 미니돼지 품종에 따라서 다르지만, 가장 소형화된 품종 중 하나인 괴팅겐 미니돼지의 경우를 보면 완전성숙 시 체중이 35 kg에 달하는 것으로 알려져 있다. 물론 이 성적은 2차 성장 후 사료급여나 영양상태에 따라서 달라질 수 있지만, 어느 면에서나 실험동물로서 용이하게 다루기는 조금 어려울 것으로 사료된다. 따라서 미니돼지의 소형화를 위해서는 사료 형태나 영양상태를 달리하는 환경적인 변화보다는 근본적인 측면에서의 소형화가 필요하다. 성장이나 외형 자체에 변화를 줄 수 있는 근본적인 측면은 바로 유전적인 변화로 유전자 수준이나 DNA 수준에서의 변화의 원인을 찾고, 그것을 지표로 하여 개량해 나가는 방법을 이용해야 할 것이다. 따라서, 이를 위해 가장 선행되어야 할 연구가 일반돼지와 미니돼지와의 성장 차이를 밝히는 연구이다. 일반돼지와 미니돼지의 성장에 차이를 보이는 유전적인 원인이 밝혀진다면, 이를 지표로 미니돼지 품종간의 성장비교가 가능해 질 것이고, 결과적으로 소형화를 위한 선발이 가능하게 될 것이다. 따라서, 본 연구에서는 미니돼지의 소형화를 위한 유전적인 지표를 찾기 위하여 미니돼지의 성장특성을 밝히고, 일반돼지와의 비교를 통한 성장에 차이를 주는 유전적인 요인을 탐구하는 연구를 수행하였다.
본 연구는 미니돼지의 기원을 밝히고, 현재까지 개발된 품종을 연구하여 미니돼지의 특성을 밝히는데 그 첫 번째 목적이 있다. 미니돼지는 그 형태나 성장특성 면에서 일반돼지와 큰 차이를 보인다. 일반돼지와 미니돼지 간의 성장차이를 연구하고, 성장에 차이를 주는 유전적인 원인을 밝히기 위해서는 먼저, 현재까지 정확하게 정리되어 있지 않은 미니돼지의 기원과 현재까지 개발된 미니돼지 품종과 각각의 특징들에 관해 정리하는 연구가 필요하다.
또한, 미니돼지의 성장특성을 분석하고, 성장 전반에 관한 고찰을 함으로써 일반돼지와의 성장에 차이를 줄 수 있는 요인을 탐구하는 연구가 실시되었다. 미니돼지와 일반돼지는 기본적으로 외형적인 크기의 차이가 있으며, 성장 시 체중에서도 그 특징들을 그대로 반영한다. 이러한 기본적인 성장특성을 밝히는 연구는 이후 시행될 유전적인 요인을 분석하는데 기초자료로 이용될 수 있다. 따라서 최종연구는 미니돼지의 성장 전반에 걸쳐서 영향을 주는 요인들을 분석하고, 구체적으로 미니돼지와 일반돼지의 성장에 차이를 주는 유전적인 요인을 탐색하는 것이다. 이렇게 밝혀진 미니돼지의 품종과 특성 그리고 일반돼지와의 성장차이와 이의 유전적인 요인 검색을 통해서 최종적으로 후보유전자들을 선정하였다.
성장에 영향을 미치는 후보유전자 검색은 주로 뼈 성장(Bone development)과 관련된 측면에서 이루어졌다. 미니돼지의 생시체중과 이후 전체적인 성장곡선에서도 제시되지만, 미니돼지는 일반돼지와 비교했을 때, 태아단계에서부터 혹은 그 이전부터 크기성장에 차이가 있는 것으로 관찰된다. 외형적인 모습뿐 아니라 다른 생리적인 기작에도 문제가 발생할 수 있는 Dwarfism이 아닌, 일반돼지에서 단지 외형적인 크기가 축소된 형태인 미니돼지는 근육의 크기가 아닌 골격의 크기에 영향을 미치는 유전자가 일반돼지와 다를 것으로 판단되어 진다. 따라서 이같은 뼈 성장에 관여하는 유전자들을 전반적으로 분석하고, 구체적인 메커니즘을 연구한다면, 미니돼지와 일반돼지의 성장에 차이를 줄 수 있는 유전적인 요인을 찾아낼 수 있을 것이라 판단하게 되어 본 연구를 진행하게 되었다.
위의 연구결과는 미니돼지와 일반돼지의 성장차이를 줄 수 있는 요인을 밝혀내는 기초자료 이상의 의미를 가질 수 있다. 만일 이러한 유전적인 요인이 돌연변이나 유전자 다형성으로 인한 DNA 수준에서의 차이가 있다면, 이를 통해서 유전자형 분석이 가능해진다. 이러한 유전자형 분석을 통해서 개체군 내에서의 유전자형 분포도를 파악할 수 있고, 통계적인 방법을 이용하여 미니돼지 개체군 내에서의 소형화 선발을 실시할 수 있게 된다. 결국 이런 방법들을 통해서 초소형화된 미니돼지를 개량하기 위한 토대를 마련할 수 있는 것이다. 이렇게 소형화된 미니돼지의 이용가능성은 실로 무궁무진하다 할 수 있다. 기존의 애완용 가축으로서의 이용가치 상승은 기본이고, 핸들링하기 쉬운 실험동물의 기초덕목을 갖출 수 있고, 소형화된 미니돼지를 관리・사육함으로써 얻을 수 있는 경제적인 효과 또한 무시할 수 없을 것이다. 하지만 이들보다 더욱 무게를 줄 수 있는 효과는 의학적인 측면이라 할 수 있다. 장기이식을 위해서 연구되는 돼지의 MHC라 불리는 SLA (Swine Leucocyte Antigens)에 관한 연구와 함께 미니돼지의 소형화를 통한 인간장기맞춤형 크기의 돼지장기 생산은 이종 장기이식을 실현시킬 수 있는 초석이 될 것이다.
미니돼지의 품종 및 분류
1. 미니돼지의 품종
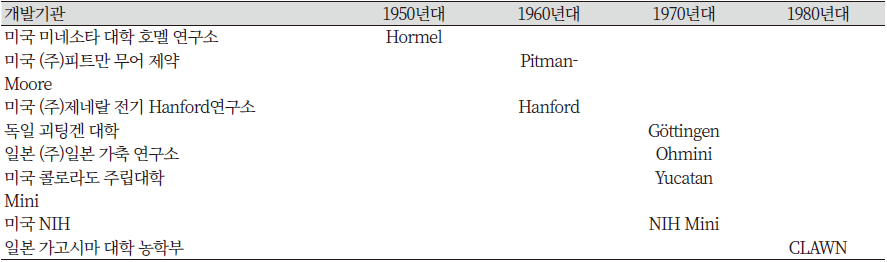
미니돼지의 개발과 이용은 주로 미국에서 주도적으로 이루어져 왔다. 최초의 미니돼지가 의료용으로 1949년에 미네소타 대학에서 개발된 이후 지난 50여 년간 세계 각지에서 다수의 미니돼지가 육종되어 활용되어 오고 있다(Table 1).
1) 미네소타(Hormel) 미니돼지
최초의 미니돼지 개발 시도는 미국에서 시작되었는데, 미국 미네소타 대학의 Mayo Clinic 병원 의사들은 외과 수술을 위한 시험 동물로 사용하였던 개 대신 사람에게 가까운 동물로 돼지를 실험동물로써 사용하고자 하였다. 그러나 시험수술이나 독성시험을 하기에는 보통의 돼지는 너무 체격과 체중이 크고 무거워 보다 작으면서 성숙체중이 사람과 유사한 작은 돼지의 필요성을 느끼게 되었다. 따라서 미네소타 대학의 호멜(Hormel) 연구소에 의뢰하여 1949년부터 미니돼지의 개발이 시작되었다(Panepinto & Linda, 1996). 이후 미네소타 미니돼지는 1965년에 미주리대학으로 분양되었으며, 여기에서 1970년대까지 외부에서 최소한의 유전자만 도입한 후 폐쇄 육종을 실시하였다. 1991년 이후로는 최소한의 근친도 향상을 위한 교배육종만을 실시하였다. 그러나 1994년에 미주리대학의 미니돼지는 싱클레어 사에 의해 인수되었다. 한편, 미네소타의 미니돼지 돈군은 1973년에 수용시설이 폐쇄되면서 뉴욕 코넬대학으로 암퇘지 50두, 수퇘지 20두가 분양되었다가 다시 시카고 의대로 옮겨졌다. 따라서 개발 초기부터의 돈군이 유지된 돈군은 시카고 의대의 미니돼지라고 할 수 있다. 이 돈군 중 24두가 2004년도에 국내의 서울대학교 의대로 분양된 바가 있다. 그러나 2004년 8월에 모돈 100두 규모의 시카고 의대 돈군이 폐쇄되었고, 미주리 수의대학의 National Swine Research Center로 12두만이 분양되었다(Figure 1).
2) 핸포드(Hanford) 미니돼지
한편, 다른 시기에 워싱톤의 핸포드 연구소(Hanford Lab)는 1958년 피트만 무어의 암퇘지와 수퇘지를 기초축으로 미니돼지 돈군을 형성한 후 루이지애나주의 늪지돼지(Swamp hog)를 도입하여 체형을 줄이는 교배를 실시하였다(Swindle et al., 1994). 핸포드 미니돼지는 140일령에 체형과, 피부색, 체모색, 피부두께 등의 심사로 엄격히 선발되어 유지시키고 있었다. 그러나 핸포드 연구소는 이 돈군을 1960년 중반에 Battele Memorial Institute로 넘겨주었고, 이 돈군은 다시 1982년에 매사추세츠주의 찰스리버 사에 넘겨졌다. 싱클레어 사가 2002년에 이 돈군을 찰스리버 사로부터 인수하면서, 현재의 핸포드 미니돼지는 완전히 폐쇄 육종을 실시하며 돈군이 유지되고 있다(Figure 2).
3) 유카탄(Yucatan) 미니돼지
유카탄 미니돼지는 멕시코 남부지역에서 체중이 40~70 kg인 소형 종을 멕시코 주민들에 의해 캘리포니아로 이주하여 1950년대부터 사육되었다. 콜로라도 주립대학은 1970년대에 캘리포니아에서 유카탄 미니돼지를 도입하여 돈군을 형성하였다(Figure 3)(Swindle et al., 1994). 그러나 재정난 등의 이유로 콜로라도주의 유카탄 미니돼지는 1986년에 캘리포니아의 S&C Farm, 1995년에 미주리주의 바이오텍 사, 2002년에 마인주의 찰스리버 사로 분양되었다. 그러나 이후 바이오텍 사의 미니돼지는 텍사스주의 Lone Star 사로, 찰스리버 사의 미니돼지는 싱클레어 사로 매각되었다. 현재 멕시코에는 외부에서 들어온 대형 종과의 교잡으로 예전의 유카탄 순종은 찾아볼 수 없다(Stricker-Krongrad&Shoemake & Bouchard, 2016).
4) 괴팅겐(Göttingen) 미니돼지
괴팅겐 미니돼지는 1960년대에 독일의 괴팅겐 대학에서 미네소타 미니돼지와 독일 동물원의 베트남 포트벨리 피그를 기초축군으로 육종된 미니돼지이다. 현재 상업적으로 판매되고 있는 괴팅겐 미니돼지는 덴마크의 Ellegaard 사가 주도하고 있다(Figure 4).
한편, 미국의 족제비, 개 등의 애완용 동물을 생산하고 판매하는 Marshall Farm은 펜실베이니아주에 Ellegaard Minipigs USA. Inc.라는 회사를 설립하여 2002년도에 괴팅겐 돼지를 덴마크로부터 입식하여 상업적으로 판매를 하고 있다.
5) 크라운(CLAWN) 미니돼지
일본의 크라운 미니돼지는 독일의 괴팅겐 미니돼지와 일본의 오미니 미니돼지를 교배한 F1과 랜드레이스와 대요크셔의 F1을 기초축군으로 교배해서 작출된 계통이다. 가고시마 대학 농학부 명예교수인 나카니시 요시히코 등에 의해, 수컷 1두, 암컷 2두를 시작으로 1978년부터 폐쇄육종 방식으로 유지된 품종이다. 당초 도입 목적은 돼지의 번식에 관한 연구였지만, 10년 이상이 지나면서 근교계통으로 확립되었다. 1990년에는 수컷 2두, 암컷 2두가 가고시마현 축산시험장으로 분양되었다. 그 특성에 대해서는 가고시마 대학과 가고시마현 축산시험장에서 연구가 이루어졌다. 또한, 1996년에는 가고시마현 축산시험장에서 미츠비시그룹의 자회사인 (주)재팬팜으로 수컷 2두, 암컷 4두가 분양되었다. 2001년 재팬팜 크라운 연구소의 개설로 재팬팜에서는 본격적인 증산을 시작하고 현재, 약 400두의 크라운 미니돼지를 사육하고 있다(Figure 5).
6) 오미니(Oh-mini) 미니돼지
1960년대 일본의 오우미 히로시(일본 가축연구소)는 미니돼지 개발 논문을 접하고, 당시 일본에서의 미니돼지 개발 필요성을 인식했다. 또한 미니돼지 개발이 의학 발전에 도움이 될 것이라는 확신하에 일본 최초의 미니돼지 개발에 착수했다. 1942년부터 1960년까지 도입한 중국 동북부에 있었던 만주돼지, 특히 소형의 돼지를 기초돈군으로 이용하였다(Figure 6)(Panepinto, 1996).
이 소형돼지는 당시 만주 지역의 하포저(荷包猪; 짐으로 쌀 수 있을 만큼 작은 돼지)로 추정된다. 기초돈군 형성 후에는 근친도를 높이기 위한 근친교배를 하였으며, 육종목표에 따라서 엄격한 선발과 도태가 이루어졌으며, 선발 기준으로는 다산성, 발육률, 원하는 체중 및 체형(지방이 적은 개체), 번식성 등의 항목이었다(Bollen&Hansen & Alstrup, 2010).
미니돼지 개발은 1961년부터 실시하였으며, 근친교배에 따른 근교퇴화 형상을 극복하고, 유전적으로 고정된 신종을 작출하여 1971년에 오미니(Ohmini)라는 새로운 미니돼지를 개발하였다.
오미니 미니돼지의 개발에는 (재)사사키 연구소, (주)다나베제약공업, (주)일본 가축연구소 등의 기관이 참여하였다. 미니돼지 개발 발표 시 오미니는 3가지 측면에서 주목받고 있었는데, 먼저 오미니는 일본에서 처음으로 개발한 미니돼지라는 것이었다. 두 번째로는 오미니 미니돼지가 그때까지 보고되었던 미니돼지와는 전혀 다른 새로운 계통의 품종이었으며, 마지막으로 초기의 미니돼지 개발은 인간의 표준체중을 목표로 육종되었지만, 오미니 미니돼지는 보다 작은 체중의 품종을 목표로 한 결과 성돈 체중이 약 35 kg 정도로 당시로서는 가장 작은 품종의 하나로 간주되었다. 오미니라고 명명한 것은, 개발 중에 방문한 외국의 과학자가 엉겁결에 'Oh! mini!'라고 놀란 것에서 유래한다는 에피소드가 있다. 현재 오미니 돼지 돈군은 겨우 명맥만이어가고 있다.
2. 미니돼지의 분류
1950년대의 미네소타 미니돼지를 선두로 1960년대에는 제약사의 피트만무어 미니돼지, (주)제너럴전기 Hanford 연구소의 핸포드 미니돼지, 1970년대의 독일 괴팅겐 대학의 미니돼지, 일본의 (주)일본가축연구소의 오미니, 미국의 유카탄 미니돼지, 미국의 NIH미니돼지가 차례대로 개발되었다. 1980년대에는 미국의 유카탄마이크로, 일본의 크라운 미니돼지가 개발된 바 있다. 이러한 미니돼지들은 그들의 이용목적에 따라서 형질이나 크기가 다르게 육종되었다.
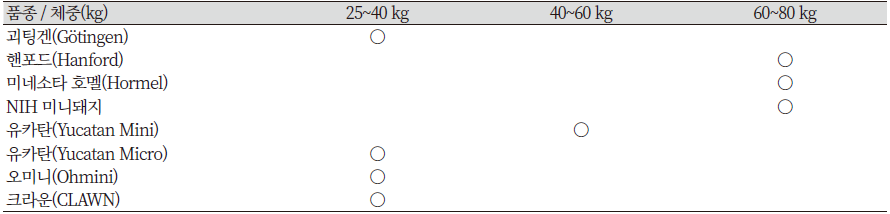
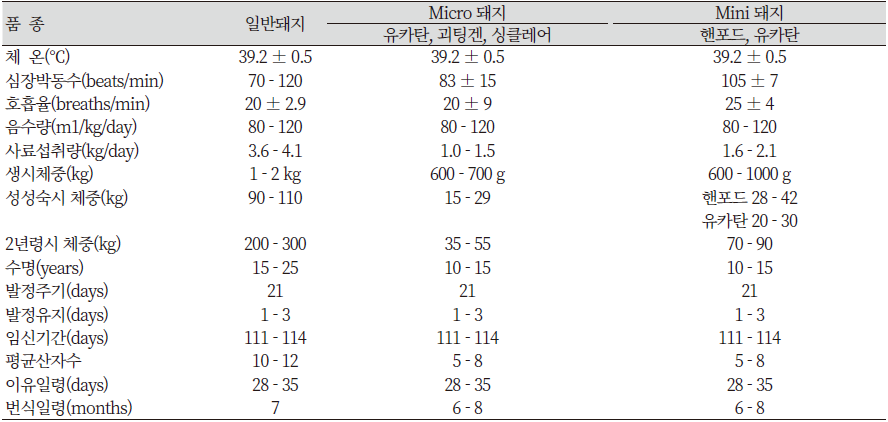
초기 개발된 미니돼지는 생체중이 사람체중과 유사한 무게를 목표로 육종되었다. 그러나 의료목적의 수술과 투약 시험용으로 관리가 용이한 작은 크기의 미니돼지가 속속 개발되면서 당초 성돈체중이 60~80 kg이었던 미니돼지가 체중 25~40 kg까지의 마이크로 미니돼지가 개발되었다(Table 2)(Bollen et al., 2010, Panepinto, 1996, Stricker-Krongrad et al., 2016, Swindle et al., 1994).
더 나아가 바이오기술이 진전됨에 따라 유전자변환 또는 클로닝된 미니돼지의 개발도 이루어지면서 미니돼지는 성숙체중 또는 유전자 조작여부에 따라 세대별로 분류되고 있다.
따라서, 성숙체중(12개월령) 60~80 kg의 미니돼지를 제1세대의 미니돼지라고 한다면 그 후 개발된 독일의 괴팅겐계나 미국의 유카탄 미니돼지는 12개월령의 체중이 30 kg 전후로 더욱 소형화 되어, 사육이 용이한 의료용 미니돼지로 세계에서 가장 많이 사용되고 있는 이들은 제2세대 미니돼지라고 할 수 있다. 일본의 오미니나 크라운 미니돼지도 범주에 들어간다. 또한, 제2세대까지의 미니돼지는 체격이 소형인 데 반해 제3세대 미니돼지는 체격이 더 작을 뿐만 아니라 유전적 특이성도 가지고 있다. 좋은 사례가 장기이식 연구를 목적으로 미국 NIH (National Institutes of Health)에서 개발된 주 조직 접합성 복합체(MHC; Major Histocompatibility Complex) 순수계통 미니돼지이고, MHC유전자형을 고정한 것이다. 이들 미니돼지는 오랜 세월 동안 교배를 계속하여 작출된 것이다. 이에 대하여 제4세대 미니돼지는, 최근 개발된 생명공학기술을 이용한 유전자조작 미니돼지를 제4세대로 분류하고 있다.
미니돼지의 성장특성 연구
1. 미니돼지 품종별 성장특성
1) 미네소타 미니돼지
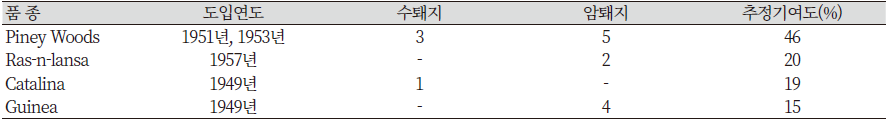
미네소타 대학의 미니돼지 생산 계획은 Mayo 병원의 연구진들의 요청에 의해 처음 계획되었다. L. M. Winter 주도로 1949년 Hormel 연구소에서는 미니돼지 개발 연구에 착수하게 되었다. 앨라배마주(Guinea pig)의 야생 돼지와 Catalina 섬의 개량종 Chester White를 기초 축군과 교배 시켰으며, 크기가 큰 개체들은 도태시켰다. 루이지애나주의 Piney Woods 돼지는 1951년과 1953년, 두 번에 걸쳐 축군을 도입시켰는데, 이는 미국에서 얻을 수 있는 돼지들중 비교적 작았기 때문이다(Bollen et al., 2010, Tumbleson & Schook, 1996).
1957년에 괌 야생종인 Ras-n-lansa 종이 4번째 종이자 마지막 도입종으로 축군에 도입되었다. 이후 축군은 작은크기의 선발 기준으로 육종되었다. 선발은 작은 체격의 선발이 가능하면서도 유전적 다양성을 가지도록 하는 것을 목표로 실시되었다. 미니돼지 축군 조성에 도입된 품종과 추정 기여도는 Table 3과 같다(Tumbleson & Schook, 1996).
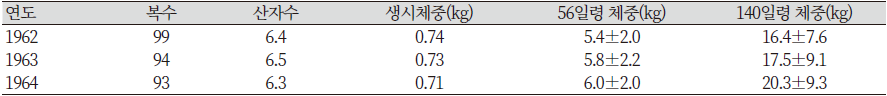
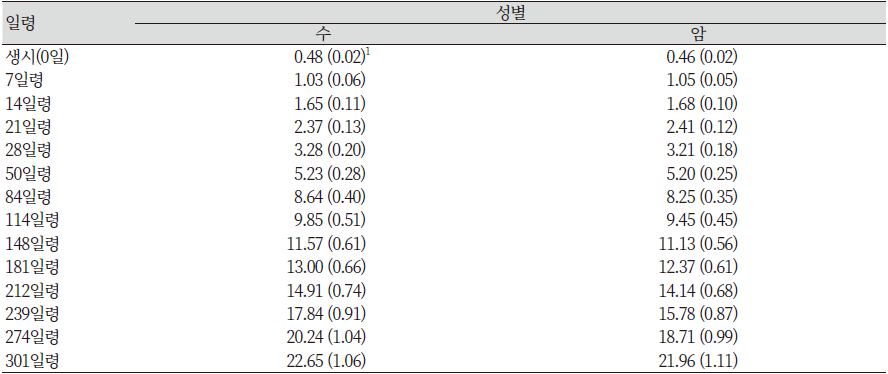
처음 2세대의 분만은 제왕절개로 실시되었다. 새로운 도입은 제왕절개에 의해 태어난 개체들만으로 실시되었다. 미니돼지를 위한 축군에 포함된 돼지들의 분만은 미경산돈 만을 대상으로 자연분만으로 실시되었다. 개발 초기 3년간 미니돼지의 4가지 형질성적과 15년 후 미니돼지 성적 간의 추정 변화량은 Table 4와 같다(Tumbleson & Schook, 1996).
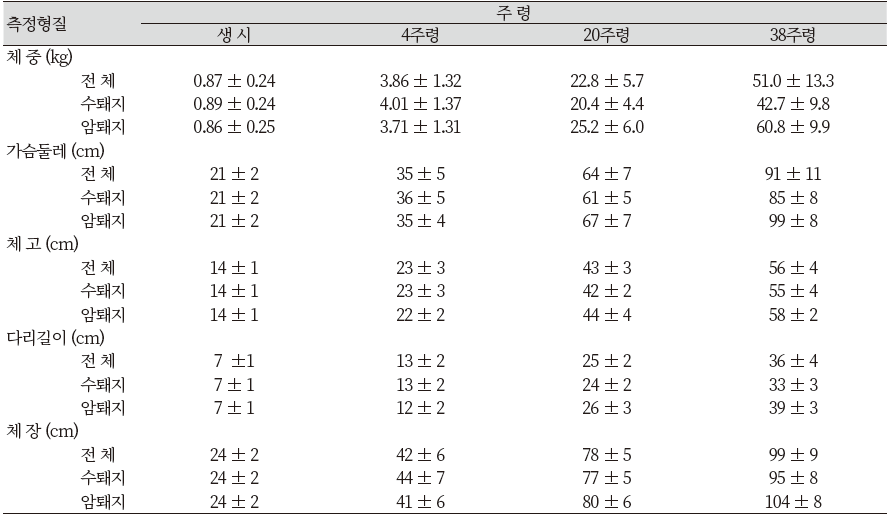
1961년 이후 미니돼지의 성적은 Table 5와 같다. 56일령과 140일령 체중이 약간 증가하는 결과를 보였는데, 이는 각 연도별 환경변이에 의한 것으로 추정된다.
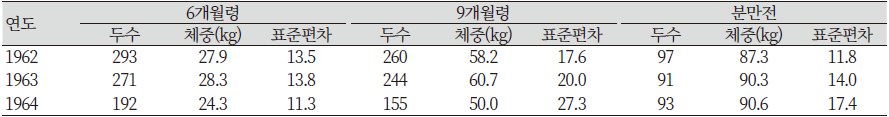
표에서도 보는 바와 같이 복당 산자수에는 변화가 없지만, 각각의 일령별 체중은 뚜렷하게 감소하는 것을 알 수 있다. 1961년에는 처음 개발을 실시할 때와 비교하여 29%의 체중 감소율을 보였던 140일령의 체중은 1962년 이후 3년간의 결과에서 40% 감소율을 보여 작은 크기로의 선발은 성공적이었다고 할 수 있다. 140일령 이후 체중은 미니돼지를 이용해 장기간 실험을 할 연구자들에게 매우 중요한 사항이다. 다양한 월령대와 임신한 미경산돈의 체중에 대한 결과는 Table 6과 같다(Tumbleson & Schook, 1996).
Table 6에서 보는 바와 같이 분만 전 암퇘지의 체중은 90 kg정도이며, 전체적으로 체중의 변이가 큰 것을 알 수 있다. 비록 그 수가 줄어들기는 했지만 몇 마리 수퇘지들은 120 kg까지 나가는 것들도 있었다. 몇 마리 암퇘지들은 90 kg 정도에서 종부를 실시하였지만 2~3년령의 일부 암퇘지들은 140 kg 정도에서 교배되는 것도 있었다(Tumbleson & Schook, 1996).
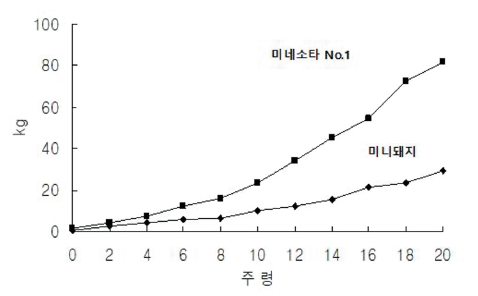
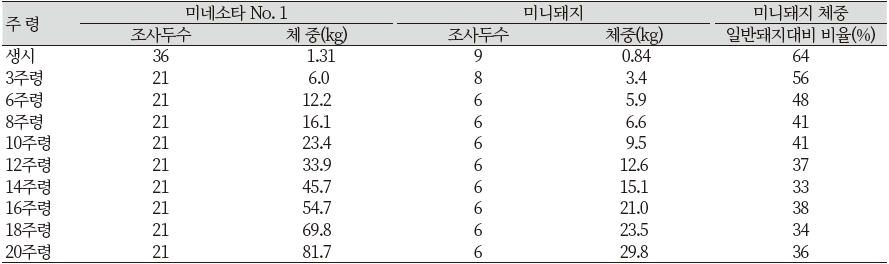
Figure 7과 Table 7은 같은 조건으로 사육된 미니돼지와 미네소타 No.1의 성장성적을 비교하여 나타낸 것이다(Tumbleson & Schook, 1996). 140일령 체중은 미니돼지가 일반돼지인 미네소타 No.1 체중에 31%정도 나가는 것으로 나타났다(Tumbleson & Schook, 1996).
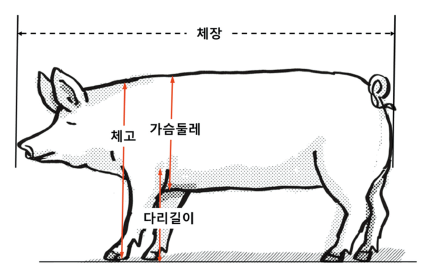
Figure 8은 일반 성장형질 측정 시 체형측정 부위를 나타낸 그림으로써, 미네소타 돼지를 중심으로 나타낸 그림이고, Table 8은 이것을 기준으로 측정한 미네소타 미니돼지의 성장형질 결과이다.
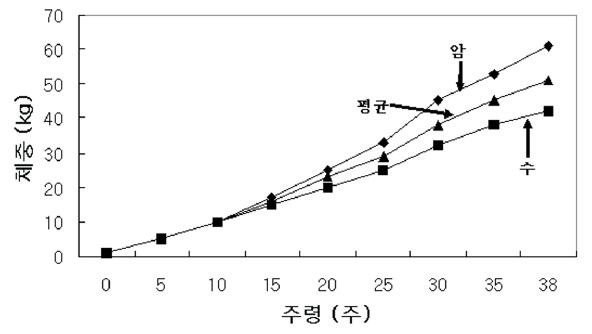
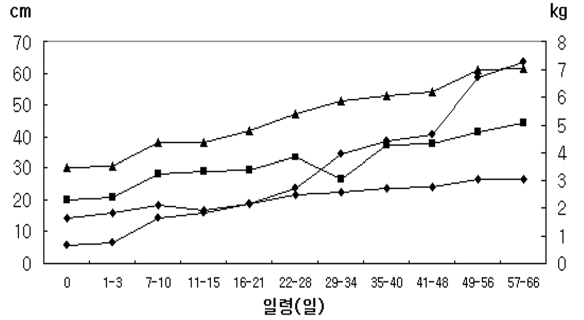
미네소타 미니돼지의 생후 9개월령까지의 체중을 분석해 본 결과, Figure 9와 같은 결과를 얻을 수 있었고, 최종 체중이 평균 약 50 kg에 달하는 것으로 관찰되었다(Hook Jr et al., 1979).
2) 핸포드 미니돼지의 개발
핸포드 미니돼지는 두 마리의 Palouse 암퇘지와 한 마리의 Pitman-Moore 수퇘지로 기초축군을 구성하였다. 첫 번째 교배의 F1의 체중은 그들 어미의 2/3 수준이었다. Pitman-Moore와 마찬가지로 밝은 피모색을 지니는 이들은 다시 흰 피모색을 지니는 루이지애나주의 swamp hog와 교배되었다. 7년간의 선발을 통해 생산된 핸포드 미니돼지의 체중은 같은 환경에서 사육한 Pitman-Moore 미니돼지와 거의 동일하였다.
번식집단의 선발은 140일령의 체중, 강건성, 피모, 피부색, 체형, 피모수, 성격과 같은 여러 가지 요인들에 기초하여 이루어졌다. 근교계수는 10~20% 정도였다. 교배는 근친도가 단기간에 높아지지 않도록 계획하였다.
2-1) 일반 성적
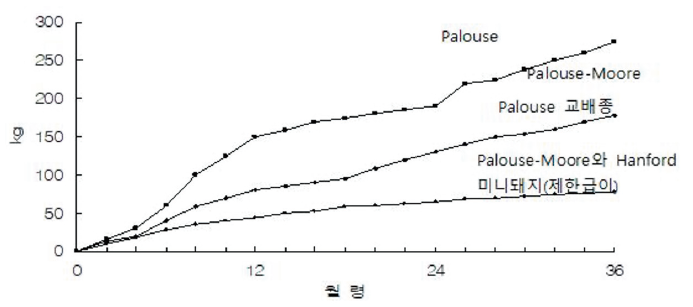
처음에는 미니돼지에게 제한급이를 실시하였는데, 6주령까지(이유 시까지)는 일일급여량을 0.23 kg으로 하였고, 6주부터 3월령까지 0.45 kg을 그리고 6개월령까지는 일당 0.9 kg의 사료를 급이 하였다. 140일령의 무제한 급여한 핸포드 미니돼지의 체중은 32 kg이었다. 초기 기초축군과 이들 자돈의 성장 패턴 결과는 Figure 10과 같다. 본 실험에 이용되었던 여러품종들의 자돈성적은 Table 9와 같다.
|
Table 9. Number of birth and weight for Palouse × Pitman-Moore, Pitman-Moore, Hanford and Hanford × Labco breeds 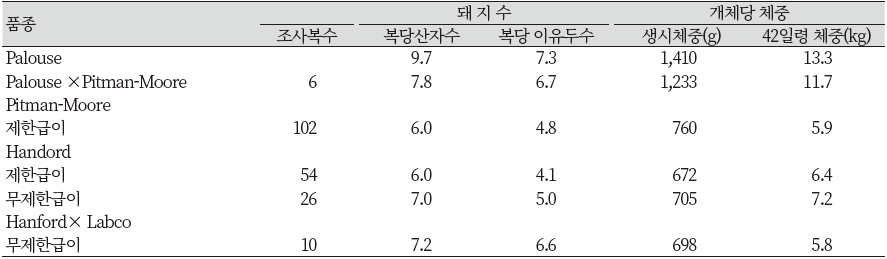
|
3) 유카탄 미니돼지의 특성
3-1) 일반적인 특성
남부 멕시코와 중앙아메리카가 원산지인 유카탄 미니돼지는 생물·의학적 연구를 위하여 유지되어왔다. 이들은 멕시코의 털없는 돼지라고 불린다. 멕시코 Frontera 근처의 유카탄반도로부터 수입된 돼지의 자손들을 이용하여 미니돼지의 기초돈군이 조성되었다. 암회색의 유카탄 미니돼지는 털이 없으며, 다루기 쉬운 유순한 성질을 가지고 있다. 많은 두수가 목 아래 가늘게 늘어진 혹(wattle)을 가지고 있는 특징이 있다. 털 없는 피부는 의학 실험 연구에 적합하며, 대부분의 다른 품종에서 나타나는 돼지 특유의 냄새가 적다. 예를 들어 수술이나 혈관을 찾기 위한 면도를 할 필요가 없다. 또한 이 돼지들은 깨끗하고 다루기 쉬워서 실내실험실 조건하에서 사육이 용이할 뿐만 아니라 야외에서 사육되더라도 다른 품종들에 비해 땅을 헤집거나 파는 행동을 덜 한다(Bollen et al., 2010, Panepinto & Phillips, 1986).
암, 수간 피부에서 커다란 차이를 보이게 되는데, 수퇘지의 경우 갑옷과 같은 각질의 plate가 어깨부위에 발달해 있다. 먼저 피부가 두꺼워지는 현상이 발생하게 되고 조직학적 모습으론 각질화된 상피조직을 가진다. 성숙하게 되면 3 cm가 넘는 두께의 각질 피부를 보인다. 암퇘지의 경우에는 좀 더 부드럽고 유연한 피부를 가지고 있다. 대사 기능 측정을 위한 실험에는 18~23℃ 정도의 비교적 따뜻한 안정된 환경을 조성이 필수적이다.
3-2) 유카탄 미니돼지의 번식능력
콜로라도 주립대 유카탄 미니돼지 집단의 복당 평균 산자수(생시)는 6.12±1.78두 이다. 경산돈의 평균 산자수는 6.22±2.13두이며, 미경산돈의 평균 산자수는 5.96±1.03두이다(Reitman et al., 1982).
일반 발정주기는 20일이며, 임신기간은 110~115일 정도이다. 성성숙은 일반 품종들과는 차이를 보이는데, 4~7월령경에 성 성숙이 오지만 첫 발정의 일령에는 덩치가 너무 작기 때문에(6개월령 시 약 20 kg)에 종부를 피하는 것이 좋다.
암, 수 합한 평균생시 체중은 0.74±0.17 kg (n=50)이며, 60일령의 평균 이유시 체중은 6.47±2.10 kg이다. 이러한 결과는 평균 생시체중 0.87±0.24로 나타난 Hormel 미니돼지보다 약간 작으며, 0.71 kg으로 보고된 핸포드 미니돼지에 비해 약간 무거운 수치이다.
3-3) 유카탄 미니돼지의 성장 특성
모돈 6복에서 태어난, 33마리의 새끼돼지의 성장속도 실험 결과를 Table 10에 나타내었고, 그래프를 Figure 11과 같이 나타내었다. 6마리의 암퇘지와 5마리의 수퇘지로 구성된 기초축군의 모든 자손들은 각별한 관리아래 실내에서 태어났다.
|
Table 10. The measurement result of postnatal growth rate in Yucatan miniature pigs 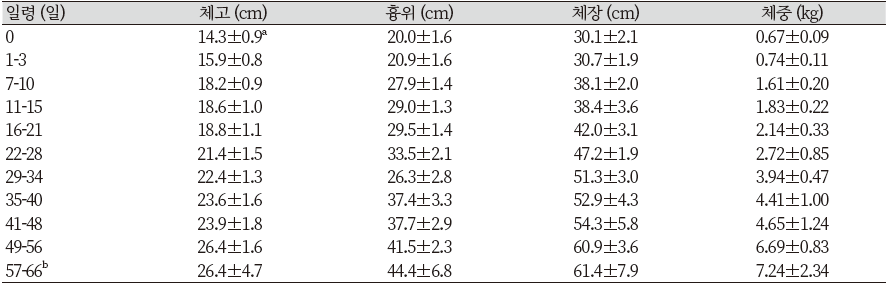
|
|
a 평균 ± 표준오차 b 겨울기간 |
새끼돼지들의 성장관련 형질 측정은 출생시부터 이유시까지 격주로 측정 되었으며, 측정은 같은 실험자에 의해 실시되었다. 측정방법은 미네소타 미니돼지와 마찬가지로 체장은 코부터 꼬리의 시작부까지의 길이로 측정하였으며, 몸통 둘레는 심장부위를 포함하는 흉위로 측정하였고, 체고는 바닥에서부터 어깨에 이르는 높이를 측정되었다.
1년령의 암, 수퇘지의 평균 몸무게는 49±9 kg 이었으며, 최대크기의 성장은 20~24월령에 이루어 졌다. 살찌지 않은 성숙한 수퇘지의 평균 몸무게는 83±12 kg 이며, 59~105 kg의 범위를 나타낸다. 성숙한 암퇘지의 평균 몸무게는 70±12 kg 이며, 40~90 kg의 범위를 나타낸다. 이러한 결과는 2~3년령의 Hormel 미니돼지의 평균 몸무게(90~136 kg) 보다 작은 수치이며, Pitman-Moore 미니돼지의 평균 몸무게(수퇘지 79 kg, 암퇘지 70 kg)와 비슷한 결과를 나타내고 있다.
무제한 급이 조건에서 암퇘지가 수퇘지에 비해 휠씬 비만하게 되는 경향을 나타냈으며, 비만한 암퇘지의 경우 140 kg 이상의 무게에 달하는 것으로 나타났다. 이러한 무게 초과는 정상체중보다 50 kg 정도 초과하는 결과이다. 성숙한 유카탄 돼지의 평균 체고와 체장은 각각 57±4 cm와 76±5 cm이다(Panepinto & Phillips, 1986, Reitman et al., 1982, 谷岡功邦, 1979).
4) 괴팅겐 미니돼지
독일의 괴팅겐 대학은 의학용 연구 목적으로 유순하면서도 경제적인 돼지 개발의 육종계획을 수행하였다. 두 가지 종류의 미니돼지를 목표로 하였는데, 피모색에 상관없이 유순한 미니돼지와 피부의학과 방사능의학 연구를 위한 백색 모색의 미니돼지 개발을 목표로 하였다. 기초축군은 베트남 돼지(Sus vittatus)와 미국의 미니돼지, 그리고 독일의 개량된 랜드레이스로 구성하였다.
베트남 돼지는 유색의 피모색을 지니면서도 유순한 미니돼지 생산을 위해 미국의 미니돼지와 교배되었다. 암퇘지는 번식능력과 모성애를 기준으로 선발하였다. 육종계획에 이용된 돼지는 85마리의 암퇘지와 13마리의 수퇘지 그리고 그들의 자돈들이었다. 1964년 당시 육종집단의 154일령 평균 체중은 17.4 kg이었다. 흰피모색의 미니돼지 개발은 작은 체형의 베트남 돼지와 흰피모색의 미국 돼지, 그리고 높은 번식능력을 가지는 개량된 독일 랜드레이스 조합으로 이루어졌다. 미니돼지의 지속적인 퇴교배를 통해 보다 작은 체형으로 육종하였다. 성숙한 미니돼지의 체고는 베트남 종, Hormel 종, 교잡종 각각 44 cm, 56 cm, 50~54 cm으로 나타났다(Panepinto, 1996, Pawlowsky et al., 2017, Swindle et al., 1994).
최근 국립수의과학검역원에서 보유하고 있는 괴팅겐 미니돼지의 자돈 26마리에 대한 체중을 분석해 본 결과, Table 11과 같은 결과를 얻을 수 있었다. 암수 간의 체중에 유의차는 없었고, 개발 당시의 약 150일령의 평균 체중과 비교해 봤을 때, 현재 자돈들의 평균체중이 약 6 kg 정도 줄었음을 알 수 있었다. 이는 괴팅겐 미니돼지의 퇴교배를 통한 작은 체형으로의 육종의 성과로 볼 수 있다.
4-1) 번식능력
조기발정과 높은 번식능력은 성공적인 육종을 위한 필수사항이다. 6~8주령 시 미니돼지 수퇘지들은 뚜렷한 성징(性徵)을 나타내었다. 8~10주령 시 성 성숙에 이르렀으며, 12~15주령 시 교배에 이용되었다. 미경산돈의 첫 발정은 9주령에 나타났으며, 완전한 성 성숙은 4~5개월령에서 6개월령 사이에 이루어졌다. 임신기간은 베트남 종 113.7일, Hormel 종 113.4일~115.3일이었다. 미니돼지 육종에 인공수정이 중요한 사항이라는 것을 알 수 있었는데, 62.5%의 미경산돈(40마리 중)과 95%의 경산돈(20마리 중)이 한 번의 인공수정에 의해 임신했다. 인공수정에 의한 복당 평균 산자수는 미경산돈의 경우 5.53마리, 경산돈의 경우 5.82마리로 나타났다.
5) 크라운 미니돼지
크라운 미니돼지의 체중은 3개월령 약 10 kg, 8개월령 약 20 kg이며, 비육용돼지의 약 6분의 1의 체중이다. 또한, 18개월령의 체중은 약 40 kg였다. 또한, 심장의 형태가 인간과 닮은 특징을 가지고 있다. 크라운 미니돼지는 가고시마 대학에서 유지·개발될 때, 학생들의 취급이 쉽도록 온순한 성격의 미니돼지가 선발되었다. 그래서 얌전한 성격이다. 또한, 귀가 큰 오미니계 미니돼지를 이용한 결과, 크라운 미니돼지는 귀가 크고 채혈이나 마취 등의 혈관을 찾기가 쉽다(Bollen et al., 2010).
재팬팜 크라운 연구소에서는 미니돼지 생산시설로 5 ha의 전용 농장을 신설하여 번식사 1동, 육성사 1동을 소유하고 있고 연간 400∼500두의 출시가 가능하다. 또 장래에는 연간 2천 두를 공급할 수 있는 규모로 확대를 계획하고 있다. 육성방법으로 생후 1월령까지는 모돈과 같이 보내고, 이유 후는 이유실에서 그룹관리 방식으로 3개월령까지 사육된다. 그 후 개체 우리로 이동, 개체관리를 실시하고 있다(Kobayashi et al., 2012).
6) 오미니 미니돼지
일본의 도치키현에 위치한 (주)일본가축연구소의 오미 히로시 박사팀이 중국 종(Manchu)을 기초축군으로 하여 새로운 미니돼지 품종을 개발하였다.
일본의 오미니 미니돼지는 등선이 아래로 휘었으며, 지방이 얇고, 검은 피모색과 늘어진 피부를 가지고 있다. 또한 큰 귀는 밑으로 처져있으며, 코가 다소 긴 것이 특징이다. 이러한 특징은 실험동물로써의 이용성을 높이고 있다.
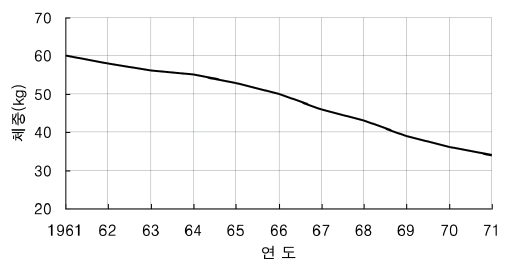
일본의 오미니 미니돼지는 1942년과 1949년, 1960년 3차례에 걸쳐 중국으로부터 들여온 15마리의 암퇘지와 4마리 중국 돼지를 기초축군으로 하여 개발되었다. 본격적인 미니돼지 생산을 위한 육종계획은 1960년에 시작하였으며, 이러한 목적에 의해 세대마다 작은체형을 대상으로 선발과 교배를 실시하였다. 이 결과 1년령 체중이 60 kg이었던 것이 1971년에는 34 kg으로 줄어들게 되었다(Figure 12).
7) NIH(National Institute of Health) 미니돼지
미국 NIH (National Institute of Health)는 1973년부터 면역적 특성이 동질화된 미니돼지 개발에 착수했다. 기초돈군은 미네소타 호멜 연구소의 암퇘지 2두와 인디애나주의 Vita Vet Laboratories의 수퇘지 1두로 구성되었다(Figure 13). 그 후손 자돈을 1두씩 피부상호이식을 통한 주조직 적합성 복합체(MHC)를 검증하는 방식으로 3년간에 걸쳐서 MHC의 특성상 3개의 순수한 계통의 미니돼지를 작출하였다. 개발 당시에는 직접적인 피부이식과 혈청반응으로 MHC의 유전자형을 구분하였으나 지금은 SLA유전자 마커로 유전자형을 구분하고 있다(Nicholls et al., 2012).
NIH의 연구결과 돼지의 MHC 유전자형이 워낙 다양하고 복잡하여 장기이식에 적합한 MHC 동질성을 지닌 돈군을 만들기 위해서는 최소한 15~20세대가 소요된다는 사실을 밝혔다.
NIH미니돼지는 보스턴 하버드대학의 MGH (Massachusets General Hospital)로 분양되어 면역적으로 현재 세계에서 이종 장기 이식용 미니돼지로 가장 적합한 돼지로 간주되고 있다.
3. 미니돼지 품종간 비교
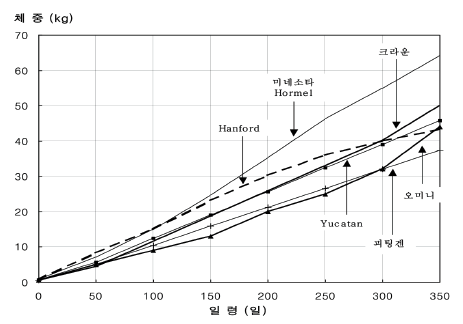
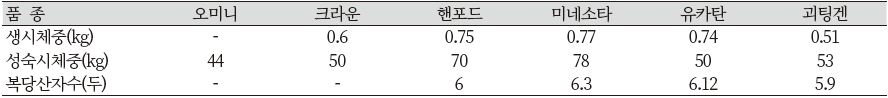
지금까지 조사한 각 미니돼지 간의 기본적인 성장과 산자수에 대한 비교는 Table 12와 같다. 또한 각 미니돼지의 1년령까지의 일령별 체중의 변화에 대한 비교는 Figure 14와 같다.
체중 비교에서 마이크로 미니돼지로 분류되는 괴팅겐과 오미니 돼지가 초기 성장 단계부터 작은 것을 볼 수 있으며, Hormel의 경우 초기성장부터 큰 체중을 가지고 각 미니돼지 중 가장 무거운 것으로 나타났다. 그 외 핸포드와 유카탄, 크라운 미니돼지는 비슷한 성장을 보이며, 1년령 체중에서도 비슷한 것을 알 수 있다.
최근에는 미니돼지의 크기에 따라서 마이크로 돼지로도 불리며, 2년령 시 체중도 미니돼지에 비하여 20~30 kg 정도 더 적게 나가는 것으로 알려져 있다. 일반돼지와 마이크로급 미니돼지 그리고 미니돼지 간의 생물학적 비교 자료는 Table 13과 같다.
성장에 관한 고찰
1. 성장의 정의
성장이란, 조직이나 기관의 전체 질량이나 크기(size)가 증가하는 현상이라고 말할 수 있다. 따라서 동물에게 있어서 성장은 시간이 지남에 따라 이러한 조직이나 기관의 수나 크기 등의 증가로 인한 외형적인 성장을 일컫는다고 할 수 있다. 이러한 성장은 세포 수준부터 관찰할 수 있고, 세포의 수적 증가나 부피 증가로 전체 성장을 대변할 수 있다(Goss, 2012).
성장은 바로 이런 세포의 성장으로서 크게 세 가지로 구분할 수 있고, 이러한 세 가지 현상에 기인한다고 볼 수 있다(Figure 15). 첫 번째는 Cell proliferation, 즉 세포분열에 의한 수적 증가로 초기 발생 과정에서 탄생 전까지 이루어지는 발달과정에서 성장으로서 가장 큰 의미를 갖는다고 볼 수 있다. 근육세포만 봐도 알 수 있듯이 세포의 수적 증가는 이러한 시기에만 일어나고 나머지 생후에 일어나는 성장에서는 세포분열에 의한 수적 증가로 인한 성장보다는 세포의 크기나 부피의 증가로 인한 성장이 대부분이다. 두 번째는 Cell enlargement, 즉 세포의 크기 및 부피 증가이다. 이것은 세포분열 과정 중에서 G0나 G1기에서 일어나거나 더 이상 분열이 일어나지 않는 세포에서 일어나는 현상으로써, 세포질의 크기 증가에 의한 전체세포 성장으로 구분지을 수 있다(Goss, 2012). 마지막으로 세 번째는 accretion of extracellular material, 즉 세포 외 물질축적 또는 세포 바깥크기 성장이다. 외부 구성물질 분비나 축적으로 인한 전체적인 세포외형의 성장으로서 뼈의 발달 과정중에서 뼈의 크기성장과 가장 큰 연관이 있다고 할 수 있다(Bilezikian et al., 2008, Goss, 2012).
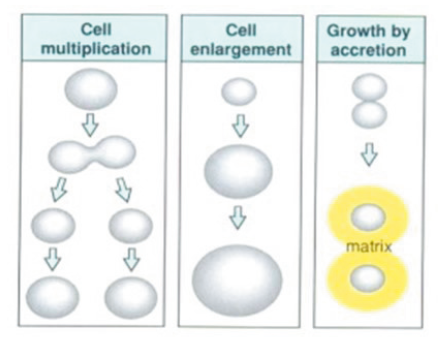
Fig. 15. The three main strategies for Growth in vertebrates. The most common mechanism is cell proliferation-growth followed by division. A second strategy is cell enlargement, in which cells increase their size without dividing. A third strategy is to increase size by accretionary growth, such as matrix secretion (Wolpert et al., 2015).
2. 성장에 영향을 미치는 요인
돼지의 성장에 영향을 미치는 요인을 크게 두 가지로 구분할 수 있다. 한가지는 유전적인 요인으로 부모로부터 물려받은 유전적인 요소로 결정된다고 볼 수 있다. DNA 염기서열이나 유전자 다형성에 의해서 성장차이가 구분되며, 품종마다 개체마다 차이가 있을 수 있다. 다른 하나는 환경적인 요인으로서 사육환경이나 사료영양에 따른 성장 발육을 들 수 있다(Emmans & Kyriazakis, 1997). 그러나 이러한 환경적인 요소들은 세대에 걸쳐서 유전되지 않고, 유전적인 능력에 따라서 같은 환경에서도 차이가 날 수 있다. 따라서 결국 성장 전반에 걸쳐서 영향을 주는 요인으로는 유전적인 요소가 영향이 크다고 볼 수 있다(Mullis, 2005).
이러한 성장은 호르몬(Hormone) 반응을 통해 일어난다(Ohlsson et al., 1993). 유전적으로나 환경적으로 성장이 일어날 때는 호르몬을 통해서 그 반응이 체내로 전달이 되며, 반응 수용체(Receptor)에 의해서 기관이나 조직 특이적으로 그 반응을 수용하고 일으킨다(Ohlsson et al., 1993). 이러한 Hormone이나 Hormone Receptor는 모두 단백질로 이루어져 있고, 이 단백질들은 핵 내에 들어있는 유전자 암호에 따라서 발현되어 진다(Mullis, 2005). 따라서 이러한 유전자 암호가 종간에 개체 간에 차이가 있을 시에는 다른 단백질, 즉 다른 Hormone이나 Receptor를 생산할 수 있고, 또는 상이한 양의 단백질을 발현시키게 된다(Ohlsson et al., 1993). 따라서 이러한 유전적인 차이가 성장의 특성이나 정도에 개체별·품종별 차이를 줄 수 있게 된다. 그리고 이러한 유전적인 차이를 밝히는 것이 미니돼지의 성장특성과 일반돼지와의 성장차이를 밝히는 결정적인 방법이 될 것이다.
Hormone은 특별한 신호가 있을 시에 분비가 되며, 적은 양으로도 효율적으로 specific하게 반응을 일으킬 수 있다(Murray & Clayton, 2013, Ohlsson et al., 1993). 대부분 세포 외에서 hormone에 특이적인 receptor에 의해서 반응을 일으키며, 이런 Receptor의 종류나 각 기관의 세포마다의 분포 차이에 의해서 hormone 반응은 특이적으로 일어날 수 있다(Murray amp;& Clayton, 2013). Hormone은 반응 메커니즘 상 대부분 1차 반응물질(ligand)로서 작용을 하며, Hormone과 결합한 Receptor의 변형에 의해 세포 내 2차 반응 전달물질(second messenger)에 의해서 핵 내로 반응이 전달되어 유전자 발현을 유도하게 된다. 이러한 유전자 발현은 각 기관에 적절한 성장물질(단백질)을 생산해 내며, 세포의 성장을 일으키게 된다(Hiller-Sturmhöfel & Bartke, 1998, Murray & Clayton, 2013, Ohlsson et al., 1993).
성장은 생명의 유전적인 특성의 하나이다. 정상적인 신체의 성장은 호르몬적인 요소와 대사적인 요소, hypothalamo-pituitary growth axis에 포함되는 다른 성장 요소 등 많은 유전적인 요인에 의한 완전한 기능이 요구된다(Hiller-Sturmhöfel & Bartke, 1998). 분자 생물학적인 방법을 적용하면 이런 hormone production과 action에 대한 기작을 이해할 수 있고, hormone의 반응을 시작할 수 있게 해주는 receptor molecule들의 특성을 파악하는데 용이하다. 또한, hormone 자극에 의한 최종 세포성 발현을 이끄는 일련의 반응들에 대한 궁금증을 해결해 줄 수도 있다. 따라서 본 연구를 위해서는 분자 생물학적인 방법을 이용하여 뇌하수체 선상(Pituitary gland)의 발달 양상과 Growth hormone의 여러 요소들, 그리고 성장단계에서 생리학적으로 중요하게 작용하는 유전자와 그들과 관련된 Growth factor 및 regulatory system을 분석할 필요가 있다.
1) 뇌하수체 발달(Pituitary gland development)
발생 초기 성장은 뇌하수체의 발달(pituitary gland development)과 함께 이루어진다. 뇌하수체의 발달을 통해서 각 시기별 특이적으로 발현되는 유전자들은 하위단계로의 반응을 전달하기 위한 hormone 등의 분비를 유발시킨다(Mullis, 2005, Murray & Clayton, 2013). 이때 뇌하수체의 발달단계에서는 Figure 16에서도 보는 바와 같이 여러 유전자들이 주요하게 작용하게 된다.
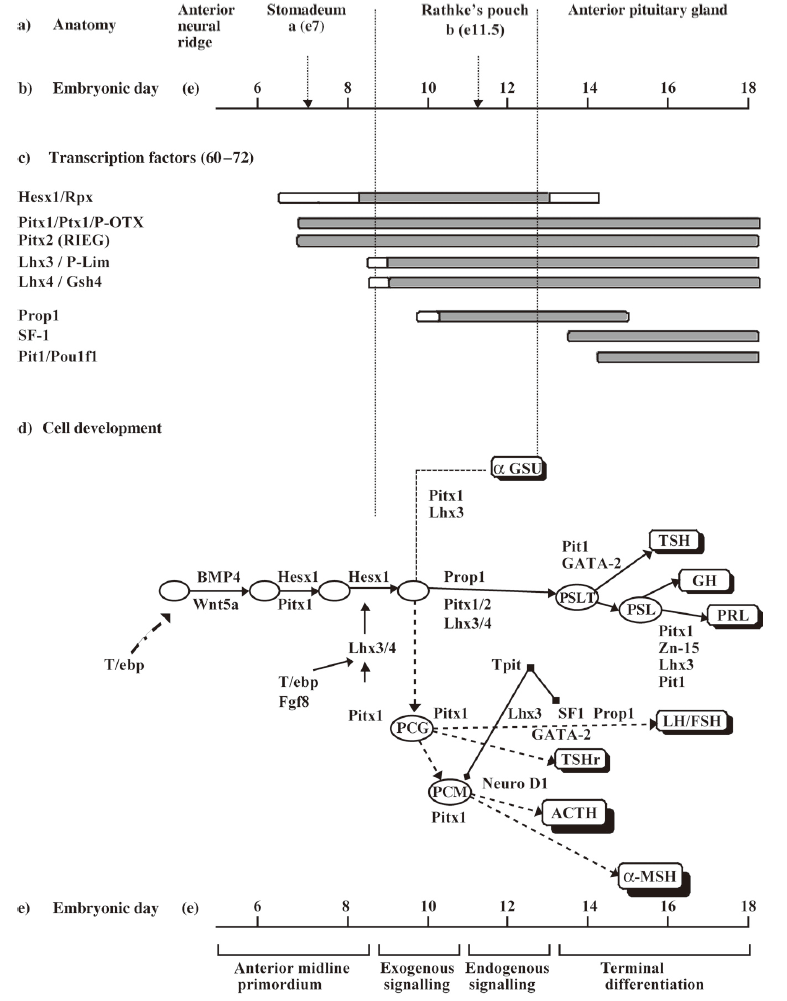
Fig. 16. Pituitary gland development. A detailed model of cell-lineage determination in pituitary ontogeny is depicted. a-MSH, a-melanocyte-stimulating hormone; aGSU, glycoprotein hormone alphasubunit; FSH, follicle-stimulating hormone; LH, luteinizing hormone; PCG, pre-cortico- gonadotrophs; PCM, pre-corticomelanotrophs; PSL, pre-somato-lactotrophs; TSHr, rostral TSH; PSLT, pre-somatolactothyrothrophs (Mullis, 2005).
BMP (bone morphogenic protein) family의 BMP2와 BMP4 같은 경우 서로 길항작용을 함으로써 뇌하수체 발달과정에서 뇌하수체 모양 형성에 중요한 작용을 하며, FGF8의 경우는 발현시기는 다르지만 이와 비슷한 역할을 수행하는 것으로 알려져 있다(Wan & Cao, 2005). 이런 유전자들에 의해서 뇌하수체 전반의 발달이 유도되고 기능이 결정된다고 볼 수 있다. 뇌하수체는 내분비적인 측면에서 가장 중요한 기관 중 하나로써 뇌에서 전달되는 신호를 각각의 기관에 전달해 주는 Hormone을 생산하는 매우 중요한 역할을 수행한다(Hiller-Sturmhöfel & Bartke, 1998). 그 예로써 성장호르몬(GH)과 성선자극호르몬(gonadotropin), 갑상선자극호르몬(TSH) 등 성장 전반에 걸친 다양한 전구물질들을 생산한다. 그리고 발생 초기에만 뇌하수체에서 발현되는 유전자로서 PIT1과 그것의 전구물질인 PROP1 (prophet of Pit1)이 있다(Deladoëy et al., 1999). 이들 두 유전자는 Pituitary transcriptional factor로서 뇌하수체에서 분비 촉진되는 거의 모든 Hormone의 분비를 유발하게 하는 주요 유전자라고 할 수 있다(Deladoëy et al., 1999). 따라서 이들 유전자가 결핍되거나 변이가 있어 정상적인 발현이 되지 않을 시에는 이후 분비되는 GH나 PRL, TSH 등 성장관련 hormone의 분비에 영향을 끼치게 되고 이후, 성장에 지장을 준다(Goss, 2012). 돼지에서 보고된 바는 없지만, human이나 mouse에서는 이 유전자들의 mutation 시 dwarf phenotype이 관찰된 바 있다(Amador‐Noguez et al., 2004). 따라서 이들 PIT1과 PROP1 유전자에 대한 분석은 이후 성장발달에 대한 원인을 분석하는데 중요한 자료로 이용될 수 있을 것이며, 미니돼지와 일반돼지와의 성장에 차이를 줄 수 있는 후보 유전자로서의 가능성도 있다고 할 수 있다.
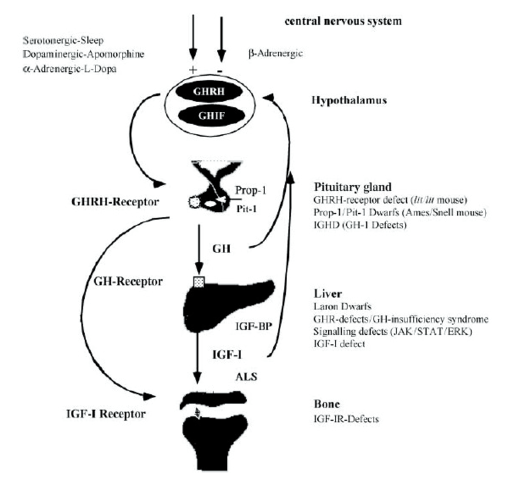
2) 성장호르몬 분비 기작(GH secretion axis)
성장 내분비인자의 분비를 뇌에서부터 이어지는 중추신경계의 흐름으로 나타내 보면 Figure 17과 같다. 교감신경과 부교감신경들의 상호 길항작용에 의해서 시상하부(hypothalamus)에서는 GHRH (growth hormone releasing hormone) 와 GHIF (growth hormone inhibition factor) 가 서로 다르게 분비된다. 이 신호를 뇌하수체(Pituitary gland)의 GHRH-receptor에 의해 전달받게 되고, 뇌하수체는 GH를 분비하게 된다(Carter-Su&Schwartz & Smit, 1996). 간에 있는 GH-Receptor는 GH의 신호를 전달받아서 체내에 전달되는 성장 중재인자인 IGF1을 분비하게 된다(Carter-Su et al., 1996). 뼈에 있는 IGF1 receptor는 최종적으로 이 신호를 전달받아 전체적인 골격성장을 유발하게 된다. 중추신경계를 잇는 이러한 GH 및 그와 관련한 조절인자들의 조절 양상에 따라 전체적인 골격성장 및 근육성장이 이루어진다고 볼 수 있다. 여러 선행 연구에서도 보고된 바에 의하면, 이러한 조절인자들의 mutation 등에 의한 결핍이나 수적인 이상현상은 Dwarf phenotype등 기형적인 양상을 불러일으키는 것으로 밝혀졌고, 결국 이 조절인자들이 성장 전반에 있어서 중요하게 영향을 끼치는 요소임을 입증하였다(Carter-Su et al., 1996, Mullis, 2005, Salvatori et al., 1999).
3) 뼈의 발달 (Bone development)
뼈의 발달은 곧 뼈의 길이성장을 의미한다고 볼 수 있다. 앞서 밝힌 바와 같이 돼지의 외형적인 성장에 가장 큰 영향을 줄 수 있는 요인은 뼈의 형성과정과 발달이라고 할 수 있다. 뼈는 신체의 골격을 형성함으로써 외형적인 크기를 결정짓는다. 외형적인 크기는 체중뿐 아니라, 체고나 체장으로 그 정도를 가늠할 수 있고, 결정적으로 이들의 측정치로 가늠한 뼈의 성장차이가 미니돼지와 일반돼지의 전체 성장차이를 대변해 준다고 볼 수 있다(Wozney et al., 1988). 따라서 전반적인 뼈의 발달에 관해서 연구가 필요했고, 이 과정 중에서 작용하는 유전적인 요소에 대해서 탐색해 보았다.
골세포(Skeletal cell)는 세 가지 다른 배아세포 계통으로부터 유래하게 된다(John P. Bilezikian., 2002). Neural cest cell은 두개골로 형성되고, sclerotome cell은 중심골격(axial skeleton)으로 형성하며, lateral plate의 중배엽 세포는 기타 부속 뼈들로 형성된다(Hall & Miyake, 2000). 체장이나 체고의 성장과 관련된 뼈 형성의 초기 단계인 sclerotome cell의 분화가 본 연구의 탐구대상이 될 수 있다. 골세포형성(skeletogenesis)은 Figure 18과 같이 크게 4가지 단계로 구분지을 수 있다.
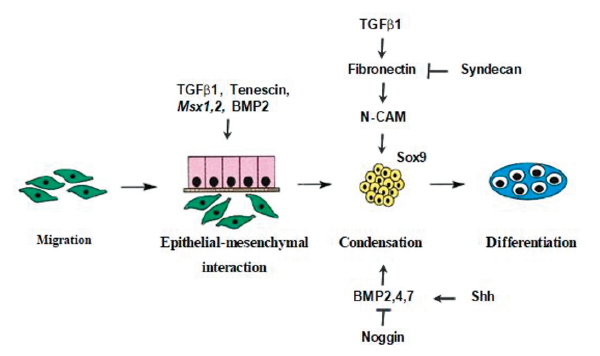
Fig. 18. The four phase of skeletal development. Migration of preskeletal cells to sites of future skeletogenesis is followed by these cells interacting with an epithelium. This in turn leads to mesenchymal condensation and subsequent differentiation to chondroblasts or osteoblasts (Hall & Miyake, 2000).
(1) 골세포형성을 위한 세포의 이주(migration), (2) epithelial cell과 mesenchymal cell의 교호작용, (3) 응축형성(condensation) 과정, (4) chondroblast나 osteoblast로의 분화 이러한 일련의 과정들을 통해서 배아세포로부터 골세포로 분화가 일어나게 된다(Daluiski et al., 2001, Hall & Miyake, 2000, Wallis, 1996). 그 중 Condensation 과정은 골격 요소들의 위치 결정이나, 뼈의 모양(shape), 그리고 크기(size)형성에 있어서 가장 중요하다. Tenescin이나 fibronectin, N-CAM 등의 상승적인 발현 조절작용으로 인한 Epithelial-mesenchymal interaction의 결과로 condensation 과정이 일어나게 된다(Hall & Miyake, 2000). 이들의 발현은 TGF-β (Transforming growth factor-β) 와 BMP(2,4,7), 그리고 FGF와 HOX 등에 의해 일어나게 되고, 특히 여러 가지 측면에서 성장과 분화에 작용하는 것으로 알려진 TGF-β와 다른 TGF-β superfamily들은 이 과정 중 가장 중추적인 역할을 수행하게 된다(Wu&Chen & Li, 2016). TGF-β isoform이나 activin, inhibin, 그리고 GDFs (Growth and differentiation factors)와 BMPs 등으로 구성된 이들 family member는 cell-cell 상호작용이나 cell-extracellular matrix 상호작용을 촉진시킴으로써 condensation에 더욱 힘을 증가시키게 된다(Wu et al., 2016). 이와 함께 mesenchymal condensation에 필요한 세포 표면 단백질의 발현을 조절하는 것으로 알려진 SOX9 유전자는 연골세포(chondrocyte)로의 분화와 형성에 필요한 가장 핵심적인 전사요소(transcription factor)라고 할 수 있다(Bi et al., 1999).
연골조직으로부터 발생되는 뼈의 형성(Bone formation)을 골형성(Endochondral ossification)이라고 한다. 이러한 골형성 과정은 매우 복잡할 뿐만 아니라, 여러 단계의 과정을 거치고, 여러 과정 중에는 연골구조의 형성과 분해의 반복이 필요하다. 이 형성과 분해의 반복을 통해서 뼈의 발달이 이루어지게 된다(Tatsumi et al., 1992). 연골조직에서 뼈로의 이러한 일련의 발달과정은 골세포 형성과정뿐 아니라, 출생 후의 성장이나, 전체 뼈의 구조형성 시에도 계속된다(Kember, 1993). 이러한 골 형성과정 중에서 뼈의 길이 성장은 바로 성장판(Growth plate)을 중심으로 이루어진다(Kember, 1993).
성장판은 크게 4개의 구역으로 구분할 수 있다. Figure 19에서 보는 바와 같이 성장판에서 가장 바깥부분에 위치하는 구역은 Reserve 구역으로 연골세포(chondrocyte)가 분화하지 않은채 작은 구형의 모양으로 산발적으로 분포되어 있다(Wallis, 1996). 이후 세포는 납작한 원반모양이 되어 일반적인 기둥모양을 이루고, Proliferation 구역을 형성하게 된다. 이 구역을 통해서 연골세포의 증식이 최대로 일어나며, 이로인해 아체(blastema)의 신장이 이루어진다. 이 구역이 거대해지면서 연골세포가 갖고 있던 원래의 원반모양의 형태를 잃어버리고 Prehypertrophic 구역(transition zone + upper hypertrophic zone)으로 접어들게 된다. 이 구역부터 세포분열에 의한 성장은 멈추게 되고, 세포의 크기(size) 증가로 인한 성장만 이루어지게 된다(Bilezikian et al., 2008, Kember, 1993, Wallis, 1996). 이를 연골세포의 성숙이라하고 이러한 크기증가 단계를 Hypertrophic 구역으로 구분한다. 세포의 이런 계속된 크기증가에 의해서 수직길이 즉, 뼈의 길이가 약 5배 가량 증가하게 된다(Bilezikian et al., 2008, Kember, 1993, Wallis, 1996). 따라서 미니돼지의 성장차이를 밝히기 위한 뼈 발달연구는 Proliferation 구역에서의 세포분열과 Hypertrophic 구역에서의 세포크기 증가, 이 두 가지 관점에서 이루어져야 할 것으로 판단된다.
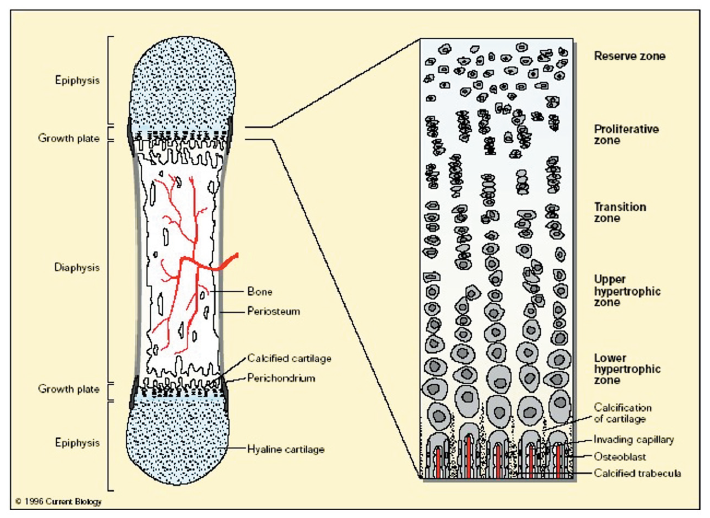
Fig. 19. Schematic representation of the organization of the mammalian growth plate. On the left is a diagrammatic representation of a long bone during embryonic development. The ossification centre that originated within the cartilage model of the bone has migrated outward toward the ends of the bone and growth plates have formed. On the right, the growth plate is expanded to show the organization and differentiation of the chondrocytes (Wallis, 1996).
성장판에서의 연골세포의 증식과 분화에 관여하는 요소는 규칙적으로 major하게 작용하는 Systematic mediator와 국부적으로 작용하는 Local mediator로 구분짓는다(Wozney et al., 1988). Systemaic mediator는 주로 hormone들로서 GH-IGF1 신호전달기작과 thyroid hormone, estrogens, glucocorticoids, 그리고 vitamin D 등이며, 탄생 전뿐만 아니라 후에도 선형으로 성장 조절작용에 관여하게 된다(Ohlsson et al., 1993). Local mediator는 hormone이 아닌 protein들로서 TGF-β, Parathyroid hormone-related protein (PTHrP)와 Indian Hedgehog(Ihh), 그리고 Fibroblast growth factor receptor3 등이 있다(Wallis, 1996, Wozney et al., 1988).
미니돼지의 성장특성을 밝히고, 일반돼지와의 차이를 밝히는 연구를 위해서는 본 연구에서 정리한 요소들에 대한 전반적인 이해가 먼저 이루어져야 하고, 이 중에서 주요하게 차이를 줄 수 있는 요소를 찾아내는 연구가 이후에 진행되어야 할 것이다. 본 연구의 결론에서는 발생 초기에 전체적으로 영향을 줄 수 있는 유전자인 PIT1의 변이에 대한 분석결과를 포함시켰고, 성장차이를 밝힐 수 있는 가능성을 제시해 보았다. 또한 이후에 진행될 연구에 관해서 서술함으로써 본 연구를 마무리하였다.
결론
본 연구의 목표는 미니돼지와 일반돼지와의 성장에 차이를 주는 원인을 밝히고, 그 원인을 중심으로 미니돼지를 소형화시킬 수 있는 마커를 찾는 최종목표를 달성하기 위한 기초자료를 제공하는 것이다. 본 연구를 통해서 현재까지 개발된 미니돼지의 품종과 기원을 파악할 수 있었고, 각 품종별 성장특성을 밝혔다. 또한 성장 전반에 관한 원리를 이해하고, 미니돼지의 성장에 영향을 미칠 수 있는 요인을 분석하였다. 이를 통해서 미니돼지와 일반돼지에 성장에 차이를 줄 수 있는 후보유전자에 대한 분석을 실시해 보았고, 가능성을 예측해 보았다. 앞으로의 연구는 이들 후보유전자들을 중심으로 앞서 서술한 연구 방법대로 분석을 실시하는 것이고, 이를 통해서 최종적으로는 미니돼지와 일반돼지와의 성장에 차이를 주는 원인을 밝혀 미니돼지의 소형화를 위한 지표로써 활용하게 될 것이다.